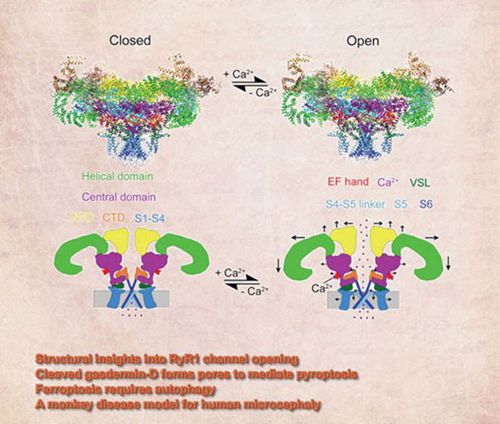
最近,尹长城教授和中国科学院生物物理研究所孙飞研究员合作,在RyR1关闭态的基础上,应用冷冻电镜解析了钙离子激活的RyR1开放态4.2Å分辨率的结构并作为封面论文发表于Cell Research。该工作揭示了钙离子激活的RyR1长程变构的结构机制,发现了RyR1通道的门控机制和RyR1通道的离子选择性机制。这些工作不仅对于理解肌肉兴奋-收缩偶联的分子机制具有重要意义,而且对于理解RyR相关的疾病的认识也具有重要意义,为治疗相关疾病提供了重要的结构线索。
在肌肉细胞中,当细胞外或者肌质网中的钙离子释放到细胞质时,会引发肌肉的收缩反应。这一过程称为肌肉兴奋-收缩偶联,是骨骼肌及心肌运动的分子基础。该过程异常将导致严重的骨骼肌及心肌疾病,包括心肌梗死等致命性疾病。参与这一过程的关键生物大分子主要有两个蛋白:位于细胞膜上的L-型钙通道亦称DHPR和位于肌浆网膜上的钙释放通道亦称RyR。当肌肉细胞接受来自与神经末梢的电脉冲信号后,首先导致细胞膜去极化,激活电压依赖的L-型钙通道;激活的L-型钙通道产生构象变化并将构象变化通过物理耦联传递到RyR而激活RyR通道,导致钙离子从肌浆网中释放,引起肌肉收缩。揭示DHPR和RyR的三维结构和相互作用及其调控是阐明肌肉兴奋-收缩耦联分子机制的基础。
北京大学基础医学院生物物理学系尹长城教授2002年从英国剑桥MRC分子生物学实验室回国后即致力于肌肉兴奋-收缩耦联分子机制研究,并于2012年策划了DHPR和RyR的三维结构研究,参与了RyR1三维结构解析,并与清华大学颜宁教授等合作于2015年应用冷冻电镜成功解析了RyR1关闭态3.8Å分辨率的结构并发表于Nature。该工作发现RyR与钾通道、钠通道和钙通道同属六次跨膜蛋白阳离子通道超家族,该结构为激动剂通过长程变构激活RyR1通道奠定了结构基础。
该工作共同第一作者为尹长城教授实验室韦日生和孙飞研究员的博士研究生王雪。尹长城教授和孙飞研究员为共同责任作者。该工作得到了中国科学院“先导计划”、科技部重大研究计划(“973计划”)、国家自然科学基金委员会、教育部“引智计划”以及中国科学院生物物理研究所生物成像中心的支持。(北京大学基础医学院科研办公室)
论文链接:http://www.nature.com/cr/journal/v26/n9/full/cr201699a.html
编辑:山石
下一篇::北大生命科学学院李程研究组发表预测和可视化异常染色体三维结构与致病基因关系的数据库网站
- 2017年天津大学成人高等教育招生简章
- 北京化工大学2018年成人高考招生简章
- 2018年首都体育学院成人高等教育招生简章
- 北京农学院2018年成人高等教育招生简章
- 2018年北京服装学院成人高考招生简章
- 北京第二外国语学院继续教育学院成考招生简章
我有话说
最新文章
- 1教育部专家组来我院开展基本

根据教育部工作部署,2018年5月24日教育部直......
- 2北京市委常委、宣传部部长杜

7月16日下午,中共北京市委常委、宣传部部长......
- 3焦宁教授研究团队在醇类分子

2018年7月6日,NatureCommunications(《自然......
- 4Nature Biotechnology报道生

2018年7月9日,北京大学生命科学学院、北大-......
- 5物理学院吕劲团队发现新型二

近年来,半导体行业总是笼罩在摩尔定律难以为......
热门文章
- 1电镜实验室高鹏等在最薄的钙钛矿
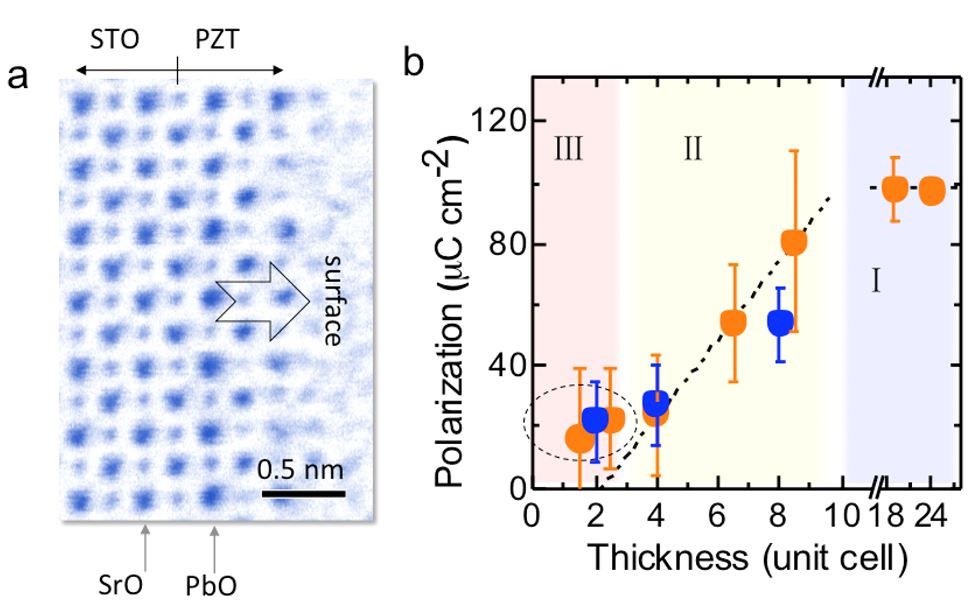
铁电薄膜在数据储存、传感、表面催化等方面...
- 2北京大学-腾讯协同创新实验室关于
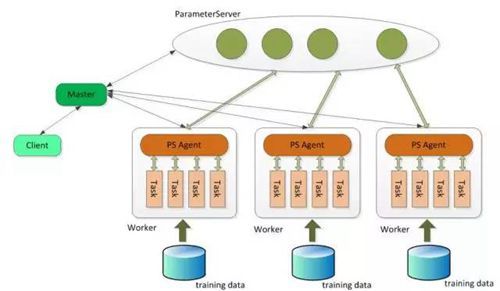
日前,《国家科学评论》(NationalScienceRev...
- 3北京大学乔杰和汤富酬团队合作研

2017年4月27日,北京大学第三医院乔杰教授团...
- 4信息学院杨玉超研究员黄如院士课
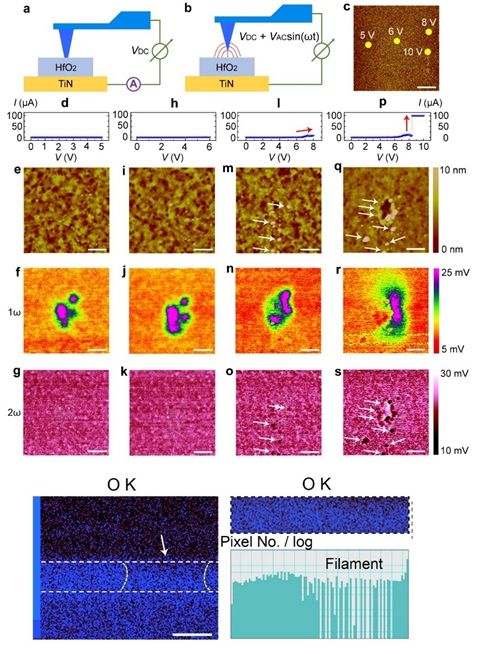
忆阻器是近年来备受关注的新型纳米器件,在新...
- 5工学院陈匡时课题组在单分子成像
最近,北京大学工学院生物医学工程系陈匡时课...



